搜索


近日,国际化学生物学领域重要学术期刊《美国化学学会化学生物学》(ACS Chemical Biolgy)在线发表了hbs红宝石平台、微生物代谢国家重点实验室冯雁团队最新研究成果《Stepwise Loop Insertion Strategy for Active Site Remodeling to Generate Novel Enzyme Functions》。博士生Md Anarul Hoque 及团队张勇博士为并列第一作者。
酶活性中心是实现高效、特异性生物催化的关键部位,对其柔性loop区的分子设计,可对活性中心微环境三维空间和残基化学组成产生重塑,进而有效驱动酶分子再进化,获得所需新催化功能。然而如何理性设计,有效引入新的多肽结构,在“老酶骨架”上产生新的催化功能,一直是酶学和蛋白质工程设计的难题。
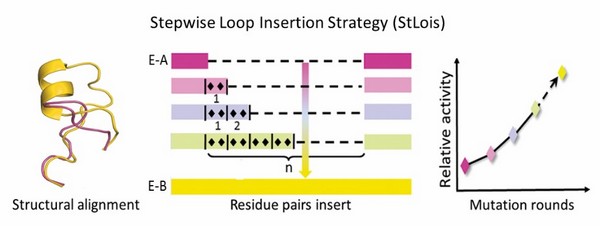
冯雁团队在对酶家族活性中心loop构象及组成分析的基础上,发展了StLois步入式loop区嵌入突变(a stepwise loop insertion strategy)的蛋白质工程新策略,从小型智能库中可快速获得所需要的突变体。研究人员以Geobacillus kaustophilus来源的高稳定性内酯酶GkaP为模式酶,应用StLois策略在活性中心中引入了2n个多肽片段,构建及筛选小型智能突变库,发现6个残基肽段(VNLGKY)的嵌入酶突变体成功地实现了向磷酸三酯酶活性的转变,相对野生型酶发生了超过107倍底物特异性改变。 更令人兴奋的是,该突变酶对一系列有机磷农药(对硫磷、地亚农和氯螨硫磷)的降解能力提升了49-1197倍,显著提升了其对环境有机磷毒物处理的实际应用价值。晶体结构及分子docking分析进一步揭示了嵌入肽段对该酶对映体底物选择性改变的作用机制,活性中心空间和极性,底物与活性中心残基结合方式,以及亲核进攻方向等改变是控制酶催化选择性转变的基础。
冯雁教授研究团队长期致力于酶分子工程和合成生物学研究,不断探索酶独特的作用机制,发展酶分子设计新策略,并将新功能酶应用于生物催化和合成生物体系中。本研究是该团队近三年来报道酶活性中心稳定化(Active Center Stabilization, ACS)(J Biol Chem, 2014,14:289; Sci Rep, 2016.6:332),关键基序介导结构域重组(Key Motif Directed Recombination, KMDR)(Chembiochem. 2015.16:3)等蛋白质工程新策略后,又一高效酶功能再塑的分子设计新成果。
该研究工作得到国家自然科学基金项目(31620103901, 31570788)的大力支持。
文章链接:http://pubs.acs.org/doi/abs/10.1021/acschembio.7b00018


 首页
首页

 学院概况
学院概况

 师资队伍
师资队伍

 人才培养
人才培养

 招生就业
招生就业

 科学研究
科学研究

 平台基地
平台基地

 党群工作
党群工作

 校友之家
校友之家

 安全工作
安全工作

 网上办事
网上办事

 当前位置:
当前位置: