搜索


近日,微生物代谢国家重点实验室冯雁课题组在美国生物化学与分子生物学学会会刊The Journal of Biological Chemistry上在线发表研究文章《Enhanced Enzyme Kinetic Stability by Increasing Rigidity within the Active Site》,建立了酶活性中心稳定化新策略,阐明了酶动力学稳定性提高的结构基础。
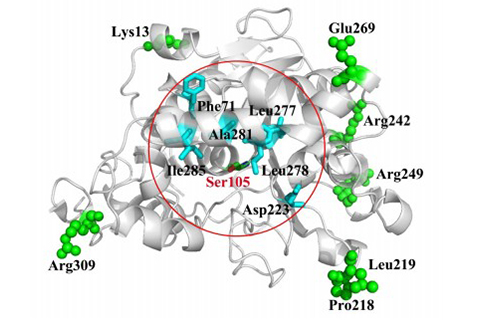

酶作为高效、环境友好的生物催化剂,在生物材料、医药、能源等工业中具有重要应用,但由于天然酶的生物学稳定性低,易失活,极大地限制了现代生物产业的发展。探讨酶稳定性机制、建立有效的酶稳定化策略已成为生物学和蛋白质工程中具有挑战性的工作。冯雁教授课题组在多年研究的基础上,提出了“酶活性中心稳定化”策略,即针对酶活性中心区域柔性较高、构象易变的特点,通过定向结构修饰来提高其刚性,从而提高酶动力学稳定性。他们以Candida antarctica脂肪酶为模式酶,围绕催化活性残基Ser附近高B因子残基进行迭代饱和突变,通过对小型智能突变库筛选,获得了既保持催化高活性,同时动力学稳定性明显提高的突变体;进一步与吴更课题组合作制备突变体晶体结构发现,组成底物通道的α螺旋形成了新的主链间氢键网络,增强了酶活性部位的刚性。这表明在保持酶活性中心原有骨架基础上,提高其内部二级结构稳定性是改善酶动力学稳定性的有效手段。
该研究不仅提出了“酶活性中心稳定化”新策略,更重要的是从区域稳定化的角度揭示了酶活性中心刚性对酶动力学稳定性的影响。“酶活性中心稳定化”策略有望为生物催化提供高稳定性新酶源,还可能为合成生物学设计、定制新型生物元件提供指导。该研究得到了国家重点基础研究发展计划项目(2012CB721003、2011CBA00800),国家自然科学基金项目(31370106),以及“863”项目(2013AA102801)的支持。
文章链接:(http://www.jbc.org/content/early/2014/01/21/jbc.M113.536045. full.html#ref-list-1)


 首页
首页

 学院概况
学院概况

 师资队伍
师资队伍

 人才培养
人才培养

 招生就业
招生就业

 科学研究
科学研究

 平台基地
平台基地

 党群工作
党群工作

 校友之家
校友之家

 安全工作
安全工作

 网上办事
网上办事

 当前位置:
当前位置: